Evaluación de la calidad de semillas de fríjol común (Phaseolus vulgaris L.) variedad Palicero en el banco de semillas de la Universidad Libre
Evaluation of the Quality of Common Bean Seeds (Phaseolus vulgaris L.) Palicero Variety, at the Seed Bank of the Universidad Libre
Artículos
Recibido: 16/12/2019
Aprobado: 27/04/2020
Autores
Romero Pintor Erika Paola
Pelayo Robelto Wendy Vannesa
Otalora Cristancho Andrés
Ortiz Villota María Teresita
Resumen
Los bancos de semillas son instrumentos de conservación del germoplasma que aseguran la diversidad genética, promueven la sostenibilidad ambiental y garantizan el derecho a la seguridad, la soberanía y la autonomía alimentaria en las comunidades. Uno de los procedimientos para evaluar la condición de los recursos genéticos está en las pruebas de calidad. Por esta razón, el objetivo del artículo fue evaluar la calidad fitosanitaria, física y fisiológica de las semillas nativas de fríjol común (Phaseolus vulgaris L.) variedad Palicero, disponibles en el inventario del banco de semillas de la Universidad Libre, cuya procedencia es del municipio de Consacá, Nariño, como estrategia de investigación y conservación del germoplasma. La evaluación de la calidad implicó las siguientes pruebas: sanidad, contenido de humedad, pureza, viabilidad, vigor y germinación, para obtener como resultado una incidencia media de patógenos del 1,23 % en la calidad fitosanitaria; en la calidad física, el 99,98 % de pureza, y el 5,01 % de humedad. Respecto a la calidad fisiológica se evidenció una viabilidad entre el 81 y el 85 % y la reducción del 10 % del potencial germinativo, lo que en general representa una condición favorable para su conservación, pese a que transcurrieron nueve meses entre la colecta y la evaluación
Abstract
Seed banks are germplasm conservation instruments, which ensure genetic diversity, promote environmental sustainability, and guarantee the right to nutritional security and food sovereignty in alimentary communities. One of the fundamental procedures to evaluate the condition of genetic resources are quality testing. For this reason, the objective of this research was to evaluate the phytosanitary, physical and physiological quality of the native seeds of common beans (Phaseolus vulgaris L.), Palicero variety, available in the inventory of the seed bank of the Universidad Libre, whose origin is from the municipality of Consacá, Nariño, as a research and conservation strategy for germplasm. The quality evaluation involved performing the following tests: sanity, moisture content, purity, viability, vigor, and germination, obtaining as a result an average incidence of pathogens of 1.23 % in phytosanitary quality; in physical quality, 99.98 % purity and 5.01 % humidity, and with respect to physiological quality, viability between 81 % and 85 % and a 10 % reduction in germination potential, which in general, represents a favorable condition for its conservation despite the fact that nine months elapsed between collection and evaluation
Introduction
La conservación de los recursos fitogenéticos es esencial para la producción agrícola sostenible; su uso eficaz contribuye a salvaguardar la seguridad alimentaria y nutricional de la población [1]. Es de notar que actualmente la diversidad genética de las semillas se ha reducido, numerosas variedades se han extinguido y otras están en vía de hacerlo; al mismo tiempo, la base genética de los principales cultivos se ha uniformado [2]. Según la Organización de las Naciones Unidas para la Agricultura y la Alimentación [3], durante el siglo XX se perdió más del 75 % de la diversidad agrícola mundial y, en la actualidad, el 80 % de nuestra alimentación proviene de tan solo doce especies vegetales.
Además, la implementación de biotecnología en las semillas por parte de empresas transnacionales que ejercen el monopolio del sistema semillero con el respaldo de leyes que favorecen sus propósitos tiene múltiples efectos: el desplazamiento de las semillas nativas, la contaminación genética, la alteración de las redes de interacción entre especies de la comunidad y el deterioro de las condiciones de los ecosistemas nativos.
En Colombia, la Resolución 3168 del Instituto Agropecuario Colombiano, expedida en el 2015, tiene por objeto “reglamentar y controlar la producción, importación y explotación de semillas producto del mejoramiento genético para la comercialización y siembra en el país" [4]. Como lo dispone la resolución, las formas de producción de semillas figuran entre los factores que limitan e impiden el sostenimiento de especies nativas. Sin embargo, pese al mérito que reviste este instrumento normativo, la reglamentación establecida ha restringido su enfoque de los cultivos que deben preservarse y ha omitido una gran variedad de semillas que son fundamentales para la conservación de la biodiversidad agrícola.
De esta manera, la desprotección de unas variedades frente a otras conduce a la eliminación tendencial de prácticas agrícolas ancestrales, inherentes a la vida campesina, que comprenden el almacenamiento y la siembra de sus propias semillas como método empírico de conservación de cultivos, procedimiento que desde sus inicios ha garantizado la calidad de estos productos agroalimentarios.
Una alternativa para contrarrestar la problemática indicada son los bancos de semillas, cuya finalidad es asegurar la diversidad local, promover y sustentar el cultivo de variedades de semillas, ofrecer sostenibilidad ambiental mediante la preservación de la biodiversidad nativa y promover el derecho a la seguridad, la soberanía y la autonomía alimentaria en las comunidades campesinas, esto debido a que se mejoran las condiciones de disponibilidad y acceso a las semillas sin restricción [1]. Al mismo tiempo, los bancos de semillas ayudan a reconstruir el tejido social comunitario a través de la defensa de las culturas tradicionales asociadas a los modos de producción agrícola, lo cual favorece la independencia productiva de las comunidades [5].
Con base en lo anterior, el éxito de la conservación de las semillas está en función de la calidad de las variedades, para lo cual se requiere aplicar procedimientos y pruebas de calidad adecuadas en los recursos genéticos, que garantizan la latencia de las semillas con óptimo rendimiento en los cultivos y disponibilidad para las generaciones actuales y futuras [6].
Este estudio se enfocó en el fríjol, por ser la leguminosa más importante para la alimentación humana [7], [8], y por constituir una de las principales fuentes de proteína en los hábitos alimentarios de grandes segmentos de la población colombiana [9]. Adicionalmente, es una fuente significativa de vitaminas, minerales y fibra [10]. Esta leguminosa de género Phaseolus es originaria del continente americano y está compuesta por cinco especies que fueron domesticadas y cultivadas de manera tradicional: Phaseolus vulgaris L., Phaseolus dumosus Macfad., Phaseolus coccineus L., Phaseolus acutifolius A. Gray y Phaseolus lunatus L., de las cuales la especie Phaseolus vulgaris L. es la de mayor importancia [7]-[11]. Según [12], el fríjol común se cultiva en 129 países de los cinco continentes; América Latina es la zona de mayor producción y consumo, y se calcula que más del 45 % del cultivado en todo el mundo proviene de esta región, donde es considerado uno de los productos básicos de la economía campesina.
En consecuencia, la presente investigación busca evaluar la calidad fitosanitaria, física y fisiológica de las semillas nativas de fríjol común Phaseolus vulgaris L., variedad Palicero, en el banco de semillas de la Universidad Libre, como estrategia de investigación y conservación del germoplasma.
1. Metodología
La investigación se llevó a cabo a partir de la colecta de semillas nativas de fríjol común de la variedad Palicero durante octubre de 2018 en la vereda Cariaco Bajo, del municipio de Consacá (Nariño, Colombia), ubicado a 1°10'40'' N de latitud y 77°27'41'' W de longitud, con temperatura media anual de 20 °C y altitud de 1663 m s. n. m.
Las semillas colectadas fueron transportadas al banco de semillas de la Universidad Libre (sede Bogotá, Colombia), donde en su momento obtuvieron un porcentaje de germinación inicial del 97 %; después, fueron almacenadas bajo condiciones ambientales y transcurridos nueve meses se realizó la evaluación de calidad fitosanitaria, física y fisiológica en laboratorio, con el fin de estandarizar los procedimientos de conservación del germoplasma. En la figura 1 se ilustra la localización del lugar en el cual se colectaron las semillas de fríjol nativo, variedad Palicero.
Figura 1. Localización de las semillas de f ríjol común de la variedad Palicero
Finalmente, para la revisión y síntesis del contenido de los artículos seleccionados, se establecieron las siguientes categorías mediante una matriz de análisis: país del estudio, objetivo general de investigación, metodología, población y tamaño muestral, y hallazgos principales sobre VSI en niños y adolescentes varones (véase Anexo 1).
1.1. Muestreo
Para obtener la muestra representativa del lote de semillas, se usó el método secuencial que, como lo exponen [13] y [14], consiste en tomar muestras primarias que provienen de diferentes envases de un mismo lote y de las distintas partes (media, baja y superior), para posteriormente mezclarlas y obtener así una muestra compuesta homogénea. Una vez llevado a cabo este procedimiento, la muestra se divide mecánicamente de manera secuencial para conseguir una muestra presentada, que es aquella con la cual se realizaron los análisis y la evaluación de calidad. El peso específico de la muestra se obtuvo según lo indicado por [15].
1.2. Calidad fitosanitaria
La identificación de los patógenos que pueden ocasionar enfermedades en las semillas requiere el método de inspección visual, el cual consiste en examinar las semillas bajo un estereoscopio [6]. El diseño experimental utilizado en esta fase fue aleatorio con tres repeticiones y grupos de genotipos por tratamiento
1.3. Calidad física
Para obtener la muestra representativa del lote de semillas, se usó el método secuencial que, como lo exponen [13] y [14], consiste en tomar muestras primarias que provienen de diferentes envases de un mismo lote y de las distintas partes (media, baja y superior), para posteriormente mezclarlas y obtener así una muestra compuesta homogénea. Una vez llevado a cabo este procedimiento, la muestra se divide mecánicamente de manera secuencial para conseguir una muestra presentada, que es aquella con la cual se realizaron los análisis y la evaluación de calidad. El peso específico de la muestra se obtuvo según lo indicado por [15].
1.3. Calidad física
La evaluación de la calidad física de las semillas se realizó mediante la caracterización según su color, tamaño y peso. El color de las semillas se estableció a partir de la tabla Munsell para tejido vegetal; mientras que el tamaño de la semilla se determinó utilizando cuarenta semillas de la muestra representativa, tomadas al azar y midiendo las variables longitud (L), ancho (A) y espesor (E). Con estas variables, se calculó el coeficiente de variación. Para el análisis de la variable peso, se tomó el peso de mil semillas (P1000S), según el método propuesto por [16], el cual consiste en determinar el peso de la semilla en ocho repeticiones de cien semillas tomadas del componente de semilla pura. Posteriormente, se calculó el coeficiente de variación para determinar si la muestra es homogénea y el P1000S se obtuvo multiplicando por diez la media aritmética de las ocho repeticiones. Para el cálculo del coeficiente de variación se usó la ecuación 1:

Dónde:
σ = desviación estándar de la muestra
μ = media aritmética de la muestra
Adicionalmente, se analizaron la pureza y el contenido de humedad, que son pruebas de calidad físicas
1.3.1. Pureza
El análisis de pureza, conforme a lo que propone [17], establece la composición porcentual pesando la muestra que se va a analizar y la composición del lote de semillas (semilla pura, otras semillas y materia inerte) que constituyen la muestra. Para este análisis, se tomó un peso de muestra de 1000 g; a continuación, se separó la muestra en sus componentes, como se definió con anterioridad y se registró su peso. Finalmente, para el cálculo de la pureza, se usó la siguiente ecuación propuesta por [15]
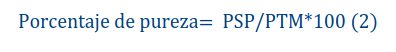
Donde:
PSP: peso de semilla pura
PTM: peso total de la muestra
1.3.2. Contenido de humedad
Se determinó por el método de secado al horno descrito por [6], en el cual se toma una muestra compuesta de diez semillas y se seca en el horno a 130 °C durante una hora; posteriormente, mediante la diferencia de peso en húmedo y en seco se conoce la humedad, con la ecuación 3
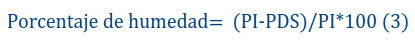
Donde:
PI: peso inicial
PDS: peso después del secado
1.4. Calidad fisiológica
La calidad fisiológica implica la integridad de las estructuras y procesos fisiológicos de las semillas, lo cual implica cuantificar su nivel de actividad por medio de la prueba de viabilidad, de vigor y de germinación
1.4.1. Viabilidad
Con la finalidad de detectar la actividad metabólica de las semillas, se llevó a cabo el ensayo topográfico de tetrazolio. Para ello, se cortaron las semillas de manera longitudinal a través del embrión con una cuchilla de acero inoxidable [18]; a continuación, se expuso el embrión de 25 semillas del lote, repetido 4 veces, a la solución de tinción concentrada al 1 % y al 0,50 % en cajas de Petri durante tiempos de exposición de 24 y 48 horas, a una temperatura de 30 °C y en ausencia de luz [19]. Finalizado el tiempo de prueba, se eliminaron los excesos de colorante con agua destilada y mediante un análisis microscópico se evaluó el patrón de tinción para clasificar las semillas teñidas totalmente como viables y las que estaban libres de coloración como no viables [18]
1.4.2. Vigor
El análisis del vigor se realizó por medio de la clasificación de las semillas en diferentes categorías, de acuerdo con el patrón de tinción y la turgencia de las simientes obtenidas de la prueba de viabilidad. Para ello, se usó la clasificación del grado de vigor propuesta por [20] y [21]:
• Vigor alto: semilla completamente turgente y teñida de color rojo.
• Vigor medio: presencia de áreas menores de color rojo o con tinción pálida, con tejidos necróticos o flácidos con una extensión limitada y de poca profundidad en cualquier lugar de la semilla.
• Vigor bajo: presencia de múltiples áreas sin tinción, tejidos flácidos o necróticos con una extensión desde 1/3 hasta 3/3 del área cotiledonar y a una profundidad de 1/2 del cotiledón hasta un cotiledón entero
1.4.3. Germinación
Las pruebas de germinación permiten evaluar la actividad metabólica de un lote de semillas y estimar su valor potencial para la siembra en campo [22]. Para realizar este ensayo se empleó el método propuesto por [15], que recomienda como medio germinativo los siguientes sustratos:
• Arena: las semillas se sembraron sobre una capa de arena húmeda y se cubrieron con un sustrato de arena sin comprimir de 1 cm de altura, para garantizar una buena aireación.
• Entre papel: las semillas germinaron entre dos capas de papel enrolladas y dispuestas de manera vertical; asimismo, se cubrió el sustrato con plástico para mantener la humedad relativa cercana al punto de saturación.
• Superficie de papel cubierto con arena: las semillas germinan en la parte superior de una hoja de papel crespón de celulosa humedecida que se cubre con una capa de arena seca de 2 cm de altura.
El procedimiento implicó el uso de la incubadora a 25 °C, teniendo como unidad experimental por sustrato 4 repeticiones de 25 semillas [22]. Las semillas tuvieron tratamiento previo para romper la dormancia (imbibición en agua durante 12 h). El primer conteo se realizó al quinto día y finalizó el noveno día, evaluando las siguientes variables: porcentaje de germinación, velocidad media de germinación (VMG) e índice de germinación, como lo expuso [23]. Se consideró como plántula normal aquella que, después de 10 días, mostrara potencial para continuar su desarrollo [24].
• Porcentaje de germinación: para calcularlo se hizo un conteo diario de las semillas con emergencia de radícula a partir del día cinco y se usó la ecuación 4 propuesta por [25]:
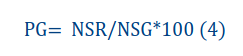
Donde:
ti: i-ésimo número de días después de la siembra
Ni: i-ésimo número de semillas germinadas
s: número total de semillas utilizadas
1.5. Análisis estadístico
Los datos obtenidos de las pruebas de germinación y viabilidad se sometieron a un análisis de varianza mediante el método Anova y a una prueba de comparación de medias con el método Tukey (p ≤ 0,05) para establecer diferencias significativas entre medias, este análisis estadístico se realizó mediante el software Minitab versión 19
2. RESULTADOS
Las semillas presentan una incidencia media de patógenos del 1,23 %, por la presencia de gorgojo inactivo en la muestra, de la especie Acanthoscelides obtectus y de la familia Curculionidae. Este resultado se obtuvo evaluando las semillas con baja condición de desarrollo y con malformaciones (figura 2).
Figura 2. Calidad fitosanitaria de las semillas de f ríjol variedad Palicero

2.2. Calidad física
Las semillas evaluadas de fríjol variedad Palicero presentan, según la tabla Munsell, un color correspondiente a 5 R 2,5/6. El análisis del coeficiente de variación reportó un valor inferior al 4,0 % para el P1000S, por lo que se considera que la muestra es homogénea y no es necesaria la toma de nuevas muestras [16]. Los resultados de la caracterización física de las semillas demuestran que el tamaño promedio (x̄) fue, para el largo, de 8,99 mm, para el ancho,de 5,19 mm y para el espesor, de 3,38 mm.
Posterior al análisis de dispersión de los datos de la variable tamaño, se manifestó mayor variabilidad para el espesor con 12,22 % y para el ancho con un 11,34 %, cuyos valores son significativos por la presencia de datos atípicos en la muestra; mientras que el resultado de coeficiente de variación obtenido para el largo fue menor con un valor del 6,77 %.
• Pureza: La pureza del fríjol palicero fue del 99,98 %, y en cuanto a la fracción de impurezas se tuvo en cuenta material inerte como ramas, piedras y otras semillas.
• Contenido de humedad: el contenido de humedad promedio en la muestra del fríjol palicero fue del 5,01 %.
2.3. Calidad fisiológica
2.3.1. Viabilidad y vigor
Los resultados de la prueba de viabilidad de las semillas evaluadas denotan que, independientemente de la concentración de la solución de cloruro de 2,3,5-trifeniltetrazolio y del tiempo de exposición, no se evidenció diferencias significativa entre los datos, de acuerdo con el Anova (p > 0,05).
En esta prueba se obtuvo una viabilidad máxima del 85 % y una mínima del 81 %; posteriormente, mediante el test de tetrazolio se logró analizar el vigor de las semillas de acuerdo con el patrón y nivel de tinción de los embriones (figura 3), lo que dio como resultado un mayor porcentaje de vigor, al implementar el tratamiento T3 (1 %, 48 h) con un 72 % y menor porcentaje de vigor para los tratamientos T1 (1 %, 24 h) y T4 (0,5 %, 48 h) con 2 % para ambos tratamientos como se evidencia en la tabla 1.
Figura 3. Comparación de la tinción y turgencia de una semilla de bajo vigor (b1) contra una de alto vigor (b2)
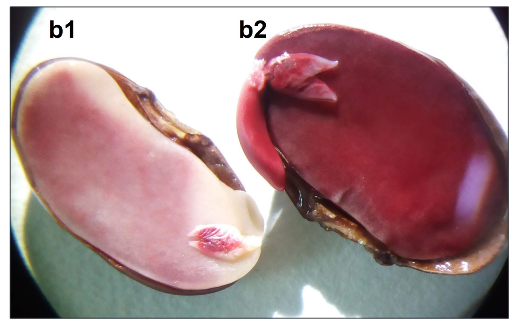
Tabla 1. Viabilidad y vigor de las semillas de fríjol variedad Palicero por prueba de tetrazolio a diferentes tiempos de exposición y concentración
| Tratamiento | Viabilidad (%) | Vigor alto (%) | Vigor medio (%) | Vigor bajo (%) |
| T1 (1 %, 24 h) | 81 | 55 | 43 | 2 |
| T2 (0,5 %, 24 h) | 83 | 55 | 44 | 1 |
| T3 (1 %, 48 h) | 85 | 72 | 27 | 1 |
| T4 (0,5 %, 48 h) | 83 | 67 | 31 | 2 |
2.3.2. Germinación
De acuerdo con la figura 4, a medida que avanzó el tiempo de la prueba, el índice de germinación de las semillas de fríjol palicero aumentó en relación lineal y de manera significativa con el porcentaje de germinación para el sustrato de arena; un comportamiento similar se obtuvo con el sustrato de superficie de papel cubierto con arena, pero con menor correlación. Respecto al sustrato entre papel, se pudo evidenciar un comportamiento distinto, puesto que la relación entre el índice de germinación y el porcentaje de germinación hasta el tercer día de evaluación tendió a ser constante y va disminuyendo conforme avanza el tiempo de prueba.
Los resultados obtenidos en la prueba de germinación de las semillas evaluadas a condiciones ambientales controladas indican que el sustrato más favorable para realizar la germinación es la arena con un 87 % de semillas germinadas y el que resultó menos favorable fue la superficie de papel cubierto con arena con un porcentaje de germinación del 46 %. La prueba de Tukey (p ≤ 0,05) estableció diferencias entre los sustratos evaluados (como se observa en la tabla 2): el sustrato con mayor VMG es para la arena con una velocidad de 2,05 semillas al día, seguido del sustrato entre papel con una VGM de 1,73 semillas/día y el sustrato de papel cubierto con arena con 0,65 semillas germinadas por día.
Figura 4. Relación entre el porcentaje de germinación y el índice de germinación de semillas de f ríjol variedad Palicero, en diferentes medios germinativos
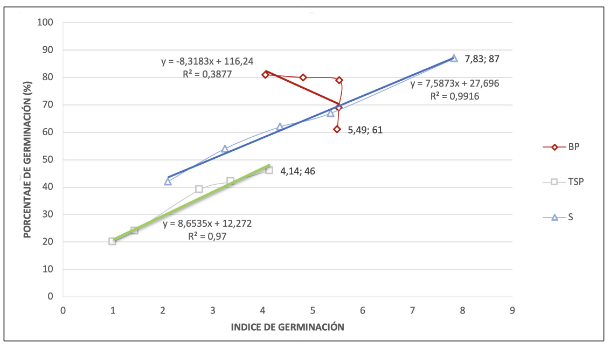
La prueba de Tukey (p ≤ 0,05) mostró diferencias entre el índice de germinación de cada sustrato, donde se presentó el valor más alto para entre papel seguido del sustrato de arena más papel, con un índice de germinación del 5,07 y 4,57 respectivamente, valores promedios que superaron significativamente el índice de germinación obtenido con sustrato de arena más papel, cuyo índice obtenido fue de 2,53 (tabla 2).
Tabla 2. Comparación de medias para las variables porcentaje de germinación (PG), velocidad media de germinación (VMG) e índice de germinación (IG) del fríjol palicero en diferentes sustratos
| Factor | PG (%) | VMG (semilla/día) | IG |
| S | 87 a | 2,05 a | 5,07 a |
| BP | 61 b | 1,73 a | 4,57 a |
| TSP | 46 b | 0,65 b | 2,53 b |
S: arena; BP: entre papel; TSP: papel cubierto con arena. Los valores de los tratamientos en la misma columna con letras distinta, indican diferencias significativas según la prueba de Tukey (p ≤ 0,05).
Respecto a la VMG, el primer día evaluado (día 5), el análisis entre papel obtuvo el valor máximo de 4,05 semillas/día, con lo que superó a los demás sustratos; sin embargo, presentó un decrecimiento significativo respecto a la arena y sustrato de arena más papel, lo que indica que en el proceso de germinación en el sustrato entre papel se presentaron variables que incidieron en la caída de la velocidad media de germinación, lo que generó diferencias estadísticamente significativas entre la arena y el sustrato entre papel como se muestra en la tabla 2
3. Discusión
Con base en los resultados obtenidos de la evaluación de calidad de las semillas de fríjol común variedad Palicero, se deduce que la condición sanitaria de las semillas evaluadas es buena; por lo tanto, puede ser controlada a partir de insumos orgánicos como: cal, ceniza, pimienta o restos de cosecha [27]. Otra técnica favorable para el control de patógenos en las semillas es la reducción del contenido de humedad, debido a que la mayoría de las especies no soportan contenidos de humedad inferiores al 9 % [28]. Esto se pudo evidenciar en la prueba fitosanitaria, en la cual se observó la presencia de gorgojo inactivo en las semillas.
Con respecto a la evaluación física de las semillas, se obtuvo que el coeficiente de varianza mostró mayor grado de dispersión de los datos para el largo y el espesor de la semilla; por otro lado, el coeficiente de varianza para el ancho se ve alterado por los datos atípicos que presentó esta variable. Este factor de variabilidad en el tamaño se puede atribuir a la incapacidad de la planta madre de proveer a cada una de sus estructuras jerárquicas igual cantidad de recursos, ya sea por restricciones físicas, fisiológicas, incidencia del medio o tipo de polinización [29]. Adicionalmente, la variabilidad genética entre plantas constituye también un factor de gran relevancia en la variación del tamaño de la semilla [29].
La pureza física y genética se ajusta a las reglas nacionales para el análisis de semillas, en las cuales se afirma que el porcentaje de pureza de un lote debe ser mínimo del 98 % [30], que en contraste con el análisis de pureza realizado en la muestra de fríjol palicero fue superior en un 1,98 %. En lo que atañe al contenido de humedad del fríjol (5,01 %), corresponde a una humedad propicia para su almacenamiento, debido a que, según [16], el contenido de humedad entre el 4 % y el 8 % es adecuada para almacenar las semillas bajo condiciones herméticas sin ningún peligro, pues ello asegura un largo periodo de almacenamiento, mínimo deterioro y conservación de la viabilidad.
Los resultados derivados de la evaluación fisiológica de las semillas denotan, por un lado, respecto a la prueba de viabilidad, que los tejidos de las semillas expuestos a diferentes tiempos y concentraciones de la sal de tetrazolio no presentan diferencias estadísticamente significativas entre tratamientos, de acuerdo con el Anova. Teniendo en cuenta lo anterior, el tratamiento que reportó mejor resultado fue el T3 (concentración del 1 % por 48 h), con un porcentaje de viabilidad del 85 %, donde se observó con mayor frecuencia una tinción roja intensa que indica la presencia de células vivas en el embrión [31]. Estos resultados coinciden con el estudio realizado por [18], en el cual se obtuvo mayor porcentaje de viabilidad al implementar el tratamiento T3 (1 %, 48 h). Por otra parte, el tratamiento en el cual se obtuvo menor viabilidad fue el T1 (1 %, 24 h) con un porcentaje del 81 %. Para el caso de las semillas inviables se tuvieron en cuenta las simientes con tinción tenue, embriones con ausencia de tinción o coloración pálida dispersa entre la radícula y cotiledones [32], lo cual indica la reducción de la actividad enzimática o presencia de tejidos muertos en las semillas. Asimismo, la prueba de viabilidad fue un factor determinante para conocer el vigor de las semillas, puesto que, de acuerdo con el patrón de tinción, se identificó el grado de vigor de las semillas, siendo el mayor porcentaje de vigor el tratamiento T3 con un 72 %. Esto indica que la vigorosidad de la semilla es alta y, por tanto, el potencial para la emergencia rápida y uniforme de plántulas a condiciones ambientales controladas será alto [33].
En cuanto al ensayo de germinación, se evidenció que el sustrato más eficiente para realizar esta prueba es la arena, con un porcentaje de germinación del 87 % y una VMG de 1,73 semillas/día, seguido del sustrato entre papel, donde se obtuvo un porcentaje de germinación del 61 % con una VMG de 2,05 semillas/día. Según la prueba de Tukey (p ≤ 0,05) la arena y el papel fueron significativamente mejores que el papel cubierto con arena; tanto en el porcentaje de germinación como en la VMG el papel cubierto con arena obtuvo valores que no son significativos en momento de realizar esta prueba, con un porcentaje de germinación del 46 % y una VMG de 0,65 semillas al día. La efectividad de la arena y el papel como sustratos coincide con el estudio que realizó [34], donde la arena desempeñó un papel relevante con un porcentaje de germinación del 88,45 % a condiciones controladas. Del mismo modo, el sustrato entre papel sobresalió al obtener el segundo mejor porcentaje de germinación con un 84,75 %. En términos generales, los tres factores que inciden en la germinación de las semillas son el sustrato, la temperatura y la iluminación [35].
Por otro lado, se evidenció que aun cuando el sustrato entre papel es propicio para realizar la prueba de germinación de las semillas, también tiende a la propagación de hongos que provocan en la semilla la pérdida de su calidad, debido a la ausencia de luz, al alto contenido de humedad y la baja oxigenación, que afectan su viabilidad y reducen su germinación [36]. Según los resultados obtenidos, a medida que avanza el tiempo, el porcentaje de germinación disminuye, al igual que la VMG, lo que se presentó por la contaminación de las semillas. Esto le produjo la pérdida de poder germinativo.
El índice de germinación tuvo una relación lineal significativa con el porcentaje de germinación para la arena, lo que coincidió con lo reportado por [25], que a medida que disminuye el porcentaje de germinación, por la contaminación de las semillas, el índice tiende a mantenerse constante (figura 4), exceptuando al sustrato entre papel. La variabilidad que se obtuvo en el porcentaje de germinación para todos los tratamientos se puede explicar en términos del índice de germinación, que, de acuerdo con [37], es una característica intrínseca y de calidad fisiológica de las semillas, reforzada por los nutrientes, reguladores de crecimiento y sustancias bioactivas liberadas cuando las semillas se embebieron en agua, y que participan en el ablandamiento de la testa; es decir, a mayor porcentaje de germinación, se presentará mayor índice de germinación, debido a la calidad fisiológica de las semillas.
Conclusiones
Las semillas de fríjol variedad Palicero presentan óptimas condiciones de calidad fitosanitaria y física, puesto que la incidencia media de patógenos es baja; de igual forma, poseen un alto porcentaje de pureza y adecuado contenido de humedad para el almacenamiento bajo condiciones herméticas.
En cuanto a la calidad fisiológica, se puede constatar tras el tiempo transcurrido entre colecta y evaluación de calidad (9 meses) que las semillas pierden su potencial germinativo de manera proporcional al tiempo y condición de almacenamiento (hermético o ambiental), como consecuencia de su envejecimiento natural.
Respecto al ensayo de germinación, se puede afirmar que la arena es el sustrato más favorable para la germinación de las semillas de fríjol bajo condiciones controladas, puesto que proporcionó mejor calidad fisiológica. Adicionalmente, en este ensayo se concluye que el papel como sustrato propició un ambiente favorable para la propagación de hongos, debido a la alta retención humedad.
Finalmente, se deduce que es pertinente efectuar las pruebas de calidad descritas en el artículo en todas las simientes del banco de semillas de la Universidad Libre para estandarizar los procesos y garantizar su longevidad
Agradecimientos
A la Universidad Libre, por destinar recursos económicos para el establecimiento del banco de semillas usado como espacio de investigación; al doctor Enrique Trujillo, por brindar asesoría científica de manera voluntaria, y a las diferentes personas que apoyaron la realización de esta investigación
Referencias
- Organización de las Naciones Unidas para la Alimentación y la Agricultura, Normas para bancos de germoplasma de recursos fitogenéticos para la alimentación y la agricultura. Roma, 2014 [en línea]. Disponible en: http://www.fao.org/3/a-i3704s.pdf
- S. R. Gliessman, Agroecología: Procesos ecológicos en agricultura sostenible. Turrialba, Costa Rica: Catie, 2002 [en línea]. Disponible en: https://biowit.files.wordpress.com/2010/11/agroecologia-procesos-ecolc3b3gicos-en-agricultura-sostenible-stephen-r-gliessman.pdf
- Organización de las Naciones Unidas para la Agricultura y la Alimentación, El estado mundial de la agricultura y la alimentación. Roma, 2008 [en línea]. Disponible en: http://www.fao.org/3/i0100s/i0100s.pdf
- Instituto Colombiano Agropecuario, Resolución 3168 de 2015 [artículo 1, título I], 2015 [en línea]. Disponible en: https://www.ica.gov.co/getattachment/4e8c3698-8fcb-4e42-80e7 a6c7acde9bf8/2015R3168.aspx
- A. Jiménez y D. Soler, “Implementación de un banco de semillas nativas y criollas como método de recuperación y conservación de la biodiversidad y desarrollo sostenible en el municipio de Ubaque – Cundinamarca” (trabajo de grado), Universidad Libre, Colombia, 2016.
- R. Kameswara, J. Hanson, E. Dulloo, K. Ghosh, D. Nowell y M. Larinde. Manual para el manejo de semillas en bancos de germoplasma. Roma: Biodiversity International, 2007 [en línea]. Disponible en: https://www.bioversityinternational.org/fileadmin/_migrated/uploads/tx_news/Manual_para_el_manejo_de_semillas_en_bancos_de_germoplasma_1261_01.pdf
- L. Barrera e Y. Santos, “Mecanismos morfofisiológicos asociados con la tolerancia a altas temperaturas en f ríjol común, Phaseolus vulgaris L.” (tesis de maestría), Universidad Nacional de Colombia, sede Palmira, 2016.
- W. Blanco, E. Sandoval y D. Torres, “Evaluación del crecimiento de f ríjol (Phaseolus vulgaris L.) cv. Ica Cerinza, bajo estrés salino”. Revista UDCA Act. & Div. Cient., vol. 19, n.º 1, pp. 87-95, 2016. https://doi.org/10.31910/rudca.v19.n1.2016.113
- T. Muhamba y M. Nchimbi, “Diversity of common bean (Phaseolus vulgaris L.) genotypes in iron and zinc contents under screenhouse conditions”, Af r. J. Agric. Res., vol. 5, n.º 8, pp. 738-747, 2010. https://doi.org/10.5897/AJAR10.304
- E. Muñoz, D. Rubio, C. Jacinto, R. Garza e I. Bernal, “Caracterización de genotipos nativos de f ríjol del estado de Hidalgo, con base a calidad del grano”, Agric. Técnica Méx., vol. 35, n.º 4, pp. 429-438, 2009.
- J. Arias, T. Rengifo y M. Jaramillo, Buenas prácticas agrícolas en la producción de f ríjol voluble. Medellín: CTP Print, 2007.
- A. Varón, “Llegó la hora de hablar de f ríjol en Colombia”, 2016 [en línea]. Disponible en: https://blog.ciat.cgiar.org/es/llego-la- hora-de-hablar-de-f ríjol-en-colombia/
- Organización de las Naciones Unidas para la Agricultura y la Alimentación, Semillas en emergencia: Manual técnico. Roma, 2011 [en línea]. Disponible en: http://www.fao.org/3/a-i1816s.pdf
- E. Trujillo, “Protocolos para la puesta en marcha del laboratorio de semillas del CINOC, áreas, funciones, equipos, métodos”, Caldas, Colombia, 2016.
- Asociación Internacional de Ensayos de Semillas, “Introducción a las reglas ISTA”. International Rules for Seed Testing, vol. 2016. https://doi.org/10.15258/istarules.2016.F
- Organización de las Naciones Unidas para la Agricultura y la Alimentación, Guía para la manipulación de semillas forestales. Roma, 1991 [en línea]. Disponible en: http://www.fao.org/3/AD232S/ad232s00.htm#TOC
- C. Gallo, R. Craviotto y M. Arango, “Pureza f ísico-botánica de semillas de soja”, Instituto Nacional de Tecnología Agropecuaria, vol. 48, 2012.
- S. Salazar y E. Botello, “Viabilidad de semillas de Glycine max (L.) utilizando la prueba de tetrazolio”, RIAA, vol. 9, n.º 2, pp. 89-96, 2008. https://doi.org/10.22490/21456453.2270
- E. Enríquez, H. Suzán y G. Malda, “Viabilidad y germinación de semillas de Taxodium mucronatum (Ten.) en el estado de Querétaro, México”, Agrociencia, vol. 38, n.º 3, pp. 375-381, 2004 [en línea]. https://inta.gob.ar/sites/default/files/script-tmp-inta-analisis-vigor-tetrazolio.pdf
- C. Gallo, J. França, M. Arango, S. González, V. Francomano, C. Carracedo, O. Costa, R. Alves, L. Magnano y R. Craviotto, “Validación de la Prueba de Tetrazolio como Método de Vigor para semillas de Glycine max. para mejorar la producción”, Instituto Nacional de Tecnología Agropecuaria, vol. 54, pp. 105-114, 2015.
- M. Monroy, C. Peña, J. García, E. Solano, H. Campos y E. García, “Imbibición, viabilidad y vigor de semillas de cuatro especies de Opuntia con grado distinto de domesticación”, Agrociencia, vol. 51, n.º 1, pp. 27-42, 2017.
- I. Rodríguez, G. Adam y J. Durán, “Ensayos de germinación y análisis de viabilidad y vigor en semillas”, Agricultura: Revista Agropecuaria, vol. 78, n.º 912, pp. 836-842, 2008.
- F. Barraza, “Germinación de semillas de Moringa (Moringa oleifera Lam.) en diferentes tiempos de imbibición en agua”, Revista UDCA Act. & Div. Cient., vol. 20, n.º 1, pp. 71-77, 2017. https://doi.org/10.31910/rudca.v20.n1.2017.64
- H. Aramendiz, C. Cardona, A. Jarma, J. Robles y R. Montalván, “Efectos del almacenamiento en la calidad fisiológica de la semilla de berenjena (Solanum melongena L.)”, Agronomía Colombiana, vol. 25, n.º 1, pp. 104-112, 2007.
- S. Islam, M. Abdul, T. Hossain, J. Ahmed y H. Khan, “Priming on embryo emergence and seedling vigor of small f ruited bitter gourd (Momordica charantia L.) under suboptimal temperatura”, Int. J. Agric. Sci., n.º 2, pp. 1-10, 2012.
- L. Amaya, B. Pita, E. Sandoval, G. Cely y P. Serrano, “Efecto de tratamientos pregerminativos en semillas de Dianthus barbatus L. cv. ‘Purple’ bajo condiciones controladas”, Ciencias Agrícolas, vol. 35, n.º 1, pp. 58-68, 2017. https://doi.org/10.22267/rcia.183501.83
- R. Aguirre, “Efecto de la humedad en el almacenamiento hermético a corto plazo de semillas de f ríjol (Phaseolus vulgaris)”, Agronomía Mesoamericana, vol. 1, pp. 35-44, 1990. https://doi.org/10.15517/AM.V1I0.25323
- R. Rodríguez y F. Herrera, “Insectos y hongos en los granos almacenados en Yucatán”, Rev. de la Universidad Autónoma de Yucatán, vol. 4, n.º 227, pp. 44-53, 2003.
- J. Garrido, P. Rey y M. Herrera, “Fuentes de variación en el tamaño de la semilla de la herbácea perenne Helleborus foetidus L. (Ranunculaceae)”, Anales del Jardín Botánico de Madrid, vol. 62, n.º 2, pp. 115-125, 2005. https://doi.org/10.3989/ajbm.2005.v62.i2.10
- Organización de las Naciones Unidas para la Agricultura y la Alimentación, Sistema de semillas de calidad declarada. Roma: 2006 [en línea]. Disponible en: http://www.fao.org/3/a-a0503s.pdf
- J. Victoria, C. Bonilla y M. Sánchez, “Viabilidad en tetrazolio de semillas de caléndula y eneldo”, Acta Agronómica, vol. 55, n.º 1, pp. 31-41, 2006.
- C. Mancipe, M. Calderón y L. Pérez, “Evaluación de viabilidad de semillas de 17 especies tropicales altoandinas por la prueba de germinación y la prueba de tetrazolio”, Caldasia, vol. 40, n.º 2, pp. 366-382, 2018. https://doi.org/10.1544 6/caldasia.v40n2.68251
- D. Manf rini, “Análisis de vigor en semillas”, Rev. Plan Agropecuario, n.º 111, pp. 56-58, 2004.
- R. Escobar, “Comparación de algunos métodos para la evaluación de la germinación en semillas de maíz (Zea Mays M.)”, Revista Agronomía Costarricense, vol. 3, n.º 1, pp. 7-11, 1978.
- J. Herrera, K. Lines y W. Vásquez, “Estudio de la germinación y la conservación de semillas de cedro maría (Calophyllum brasiliense)”, Tecnología en Marcha, vol. 19, n.º 1, pp. 61-72, 2006.
- N. M. Ghangaokar y A. D. Kshirsagar, “Study of seed borne fungi of different legumes”, Trends in Life Sciences, vol. 2, n.º 1, pp. 32-35, 2013.
- F. Barraza, O. Benavides y F. Torres, “Calidad fisiológica y energía de germinación de semillas de balsamin (Momordica charantia L.)”, Rev. de Ciencias Agrícolas, vol. 33, n.º 1, pp. 43-52, 2016, https://doi.org/10.22267/rcia.163301